【摘要】
目的: 通过对胫骨下段缺损假体重建后的模型进行有限元分析,了解假体重建模型各个部位的应力、形变,明确结构的初期强度,为临床应用提供理论依据。
方法: 采集 1 名正常成年人胫腓骨薄层 CT数据,采用 Mimics 软件进行胫腓骨及踝关节三维重建。通过 Solidwork 软件构建正常胫骨 -腓骨 -距骨模型与假体重建胫骨远端骨缺损模型。通过 ANSYS 软件应用有限元法进行力学分析。螺钉与假体的接触关系为绑定接触,假体与皮质骨的接触关系为滑移接触,螺钉与皮质骨的接触关系为绑定接触。在胫骨平台上施加600 N 的垂直模拟载荷,以模拟人体单足站立时胫腓骨的状态,来评估和比较不同重建模型的应力和位移变化。在胫骨平台上的中立位施加 600 N 的垂直载荷,同时,再以胫骨的纵轴为旋转中心,施加 2.7 N·m 的顺时针和逆时针力矩,以模拟下肢的外旋载荷和内旋载荷。
结果: 在施加 600 N 垂直应力于胫骨平台时,正常胫腓骨模型的最大 von Mises 压应力为 8.27 MPa,von Mises 压应力的集中区域为胫骨中段后方皮质骨。模型最大形变部位在胫骨平台外侧及腓骨头,形变距离为 4 mm。施加 2.7 N·m 的顺时针和逆时针力矩时,最大 von Mises 压应力为 14.25 MPa,位于胫骨中段皮质,位移最大点位于胫骨近端前方皮质,为 2.47 mm。在模拟单腿站立时,假体模型的最大 von Mises 压应力为 51.98 MPa,位于假体远端的 1 枚交叉螺钉处,模型的其余部分受力均匀。形变分析结果显示假体重建模型最大位移小于正常胫腓骨模型,仅为 0.74 mm,位于胫骨平台外侧及腓骨头,部位与正常胫腓骨模型一致。施加 2.7 N·m 的顺时针和逆时针力矩,最大 von Mises 压应力为 15.44 MPa,位于假体远端的抗旋转螺钉处,旋转时位移最大点位于胫骨平台外侧与腓骨头接触部位,仅为0.07 mm。结论 胫骨下段 3D 打印踝关节融合型假体重建胫骨下段恶性骨肿瘤切除后的骨缺损模型中假体及骨受力均匀,稳定性好,理论上是可靠的重建方式。
【关键词】 胫骨;骨肿瘤;假体植入;打印,三维;有限元分析;缺损,骨
胫骨远端的原发恶性肿瘤或侵袭性肿瘤在临床中非常少见,其中恶性肿瘤以骨肉瘤 (osteosarcoma,OS)、尤文肉瘤 (ewing sarcoma,ES) 为主,侵袭性肿瘤主要为骨巨细胞瘤 (giant cell tumor of bone,GCT) [1-2]。胫骨远端邻近踝关节,软组织覆盖薄弱,血运较差,发生在此处的恶性或侵袭性骨肿瘤广泛切除重建术后并发症较多,膝下截肢 (below knee amputation,BKA) 曾经是治疗的主流手段 [3]。20 世纪 80 年代,新辅助治疗的开展以来,影像诊断技术的进步,外科操作的精进,使得保肢成为可能。由于该类患者在临床十分少见,即使国内外大的骨肿瘤中心,也没有成熟的治疗经验,文献中关于该病的治疗记录多为个案报道或小宗病例报道。因此,胫骨远端肿瘤切除后大段骨缺损的重建策略多种多样,主要包括非生物重建 (金属假体重建) 和生物学重建,生物学重建包括大段异体骨重建、自体骨重建 (灭活再植、自体腓骨等) 以及骨搬运等 [1-2,4-5]。
肿瘤型胫骨远端假体的研究较少,目前文献中的报道多为近、中期的假体置换的疗效报道,且并发症发生率较高。近年来,随着数字骨科技术的飞速发展,3D 打印技术及骨长入界面的应用使得假体重建的术后并发症降低。本中心前期研究表明胫骨下段 3D 打印踝关节融合型肿瘤假体重建胫骨下段恶性骨肿瘤切除后的骨缺损安全、有效,融合率高,术后早期功能满意 [6]。本研究拟通过对胫骨下段缺损假体重建模型进行有限元分析,观察各个部位的应力、形变,明确结构的初期强度,为临床应用提供理论依据。
一、三维模型的建立
选取 1 名 24 岁健康男性志愿者,签署知情同意书。该自愿者身高 168 cm,体重 60 kg。将其右下肢置于中立位进行 CT 断层扫描,扫描范围为膝关节至足踝。原始 CT 数据以 Dicom 格式导入 Mimics 软件(Materialise 公司,比利时),根据不同灰度值的 CT图像建立皮质骨、松质骨和髓腔,获得正常胫骨 -腓骨 -距骨三维 CT 模型。
以正常胫骨 -腓骨 -距骨模型为基础,重建胫骨骨缺损的三维模型,根据既往临床资料模拟胫骨远端缺损长度为 13 cm。假体模型以缺损模型为基础建立,通过 CT 数据设计合适大小胫骨远端假体,假体形状与正常骨匹配,假体远端为 3D 打印短柄插入距骨内,假体远端由 3 枚螺钉固定距骨、跟骨,其中 1 枚螺钉穿过假体远端短柄,用于对抗旋转,称之为抗旋转钉 (图 1)。假体模型由北京力达康公司 (中国) 提供,假体为组配式,胫骨远端基本段为 3D 打印模块,远端关节面为骨小梁结构,且含有一长约 1.0~1.5 cm 的短柄,插入到距骨中,并有1 枚螺钉可以穿过用来抗旋转 (图 2)。术中可根据骨缺损长度,将胫骨远端假体与不同长度延长段假体组配。
二、网格划分
正常胫骨 -腓骨 -距骨模型、假体重建模型在Mimics 软件中通过布尔运算方法装配,以 iges 格式导出模型,并导入 Hypermesh 14.0 软件 (Altair 公司,美国) 中进行网格划分,单元的网格划分为2 个步骤进行:首选用长度为 2 mm 的单元对模型进行整体划分,然后用长度为 1 mm 的单元对模型的结合部和可能的应力集中部位进行进一步划分,并对质量较差的网格进行手动修改。
三、材料参数
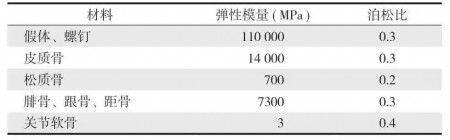
所有材料假设为连续、均质、各向同性的线弹性材料。根据既往文献报道,胫骨皮质骨和松质骨的弹性模量分别为 14 000 MPa 和 700 MPa,泊松比分别为 0.3 和 0.2 [7-9]。假体、螺钉的弹性模量和泊松比分别为 110 000 MPa 和 0.3 [10-11]。材料属性见表 1。
四、接触关系
螺钉与假体的接触关系为绑定接触,螺钉与皮质骨的接触关系为绑定接触,假体与皮质骨的接触关系为滑移接触,其余的接触关系均为绑定接触。
五、有限元分析
将模型导入 Ansys 17.0 软件 (ANSYS 公司,美国) 进行有限元分析,在胫骨平台上施加 600 N 的垂直模拟载荷,以模拟单足站立时胫腓骨的状态,来评估和比较不同重建模型的应力和位移变化。在胫骨平台上的中立位施加 600 N 的垂直载荷,同时以胫骨的纵轴为旋转中心,施加 2.7 N·m 的顺时针和逆时针力矩,以模拟下肢的外旋载荷和内旋载荷。有限元分析时将距骨、跟骨固定,其自由度为 0。非线性运算采用 Ansys 软件自动迭代求解,每次分析进行 28 次平衡迭代。测量整个有限元模型的应力集中点和各个组成部分的应力变化、位移。
表1 有限元采用的材料属性
正常胫骨 -腓骨 -距骨模型约包含 52 898 单元和 89 309 节点。在施加 600 N 垂直应力于胫骨平台,即模拟单腿站立时,该模型的最大 von Mises 压应力为 8.27 MPa,von Mises 压应力的集中区域为胫骨中段后方皮质骨 (图 3)。通过对模型进行形变分析,发现模型最大形变部位在胫骨平台外侧及腓骨头,形变距离为 4 mm (图 4)。在胫骨平台上以胫骨的纵轴为旋转中心,施加 2.7 N·m 的顺时针和逆时针力矩时,以模拟下肢的外旋载荷和内旋载荷,最大 von Mises 压应力为 14.25 MPa,位于胫骨中段皮质,位移最大点位于胫骨近端前方皮质,为 2.47 mm(图 5)。
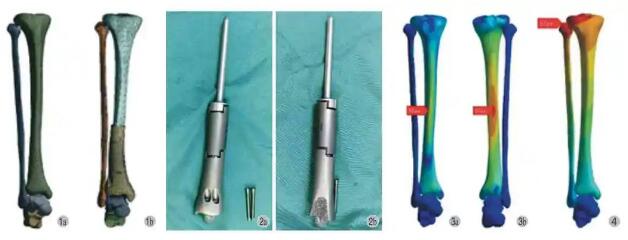 图1 a:正常胫骨 -腓骨 -距骨模型;b:假体重建模型
图1 a:正常胫骨 -腓骨 -距骨模型;b:假体重建模型
图2 3D 打印踝关节融合胫骨下段假体照片
图3 施加 600 N 垂直载荷时正常胫骨 -腓骨 -距骨应力分布图
图4 施加 600 N 垂直载荷时正常胫骨 -腓骨 -距骨形变分布图
假体重建模型包含 78 412 单元和 132 712 节点。在模拟单腿站立时,假体模型的最大 von Mises压应力为 51.98 MPa,位于假体远端的 1 枚交叉螺钉处,除此之外,模型的其余部分受力均匀 (图 6)。形变分析显示假体重建模型最大位移小于正常胫腓骨模型,仅为 0.74 mm,位于胫骨平台外侧及腓骨头,部位与正常胫腓骨模型一致 (图 7)。在胫骨平台上以胫骨的纵轴为旋转中心,施加 2.7 N·m的顺时针和逆时针力矩,最大 von Mises 压应力为15.44 MPa,位于假体远端的抗旋转螺钉处 (图 8),位移最大点位于胫骨平台外侧与腓骨头接触部位,仅为 0.07 mm (图 9)。
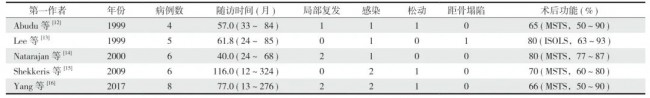
目前,尚没有胫骨远端原发骨肿瘤切除后大段骨缺损重建的金标准,究其原因,正是由于病例数少见,无法进行较大样本的临床疗效对比研究。胫骨远端肿瘤切除后进行肿瘤型假体置换的优势明显,主要为手术时间缩短,金属的力学强度远优于异体骨和灭活骨,可以实现早期稳定,术后不需要长时间制动,可早期功能锻炼。但传统胫骨远端假体的缺点主要有术后感染率高,随着时间的延长,逐渐出现假体相关并发症 [12-16],如无菌性松动、感染、距骨塌陷、皮肤坏死 (表 2),进而导致胫骨远端功能的逐步损失 [12]。笔者团队对既往文献进行了系统综述,结果显示与传统假体重建相比,生物学重建可以得到较为满意的临床效果 [1]。Stevenson等 [17] 和 Grimer 等 [18] 分别报道了肿瘤型假体置换后的中、长期结果,无菌性松动和感染是假体重建失效的主要原因,在整个随访过程中,深部感染的风险持续存在,且以平均每年 1% 的发生率增长。因此,本中心在早期并未开展假体置换。
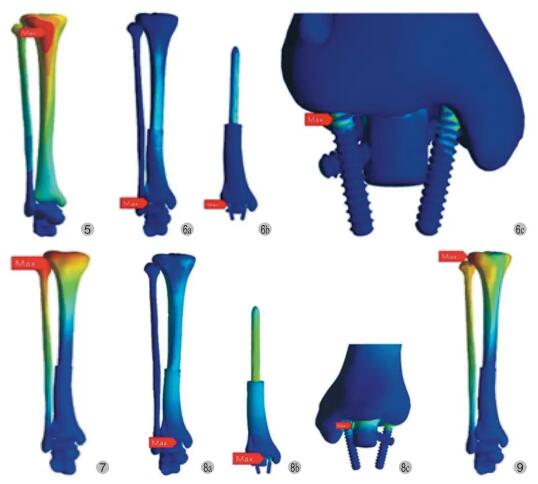 图5 施加 2.7 N·m 的顺时针载荷时正常胫骨 -腓骨 -距骨形变分布图
图5 施加 2.7 N·m 的顺时针载荷时正常胫骨 -腓骨 -距骨形变分布图
图6 施加 600 N 垂直载荷时假体重建模型应力分布图
图7 施加 600 N 垂直载荷时假体重建模型位移分布图
图8 施加 2.7 N·m 的顺时针载荷时假体重建模型应力分布图
图9 施加 2.7 N·m 的顺时针载荷时假体重建形变分布图
表2 文献中关于假体置换治疗胫骨远端肿瘤切除后骨缺损的研究
注:MSTS:骨骼肌肉肿瘤协会 (Musculoskeletal Tumor Society,MSTS) 功能评分;ISOLS:国际保肢学会 (International Society of Limb Salvage,ISOLS) 功能评分
随着近几年 3D 打印技术的发展,有望减少假体相关并发症。3D 打印人工假体的技术优势主要体现在两个方面:一是适形匹配,二是骨整合功能。对胫骨下段的修复重建,3D 打印技术提供了一个比较理想的策略。通过 3D 打印可以制作出大小、形状匹配的胫骨下段缺损,在与距骨的接触界面上制作供骨长入的金属骨小梁结构,最终实现与自体距骨的骨性融合。本中心自 2017 年开始使用 3D 打印假体治疗胫骨远端骨缺损,取得了良好的临床效果 [6]。本研究采用有限元分析方式对该重建模型在模拟人体站立受力及旋转情况下的应力及位移变化。
由于踝关节缺乏良好的肌肉覆盖,术后容易出现并发症。使用 3D 打印技术可以设计出等比例减小体积的胫骨远端假体,增加软组织覆盖,利于伤口的闭合,减小了术后伤口缺血坏死的发生率。假体采用组配式,可以组合出任意长度,且假体柄有足够的强度承重,骨折等机械性并发症发生率显著降低,允许患者早期负重。
有限元分析结果也表明,假体重建模型的应力分布均匀,早期应力集中点位于假体远端螺钉处,仅为 51.98 MPa。模拟单腿站立时,假体重建模型的位移分布图与正常胫骨 -腓骨 -距骨模型基本一致,侧面说明此种重建是适形、匹配的。此外,假体重建模型的抗旋转能力也得到有效证实,在胫骨平台上以胫骨的纵轴为旋转中心,施加 2.7 N·m 的顺时针和逆时针力矩,最大 von Mises 压应力仅为15.44 MPa,位于假体远端的抗旋转螺钉处,说明远端抗旋转螺钉使用的必要性及有效性。
本研究有以下局限性。首先,有限元分析有其局限性,本研究没有对实际的病例作动态或静态的生物力学的测定,如术后患者的步态及应力分布。其次,目前来看,3D 打印假体的初期临床疗效较好,但仅限于短 -中期随访,仍需长期随访验证。此外,有限元加载条件相对简单,因此重建方式为踝关节融合,患者踝关节屈伸、旋转功能已丧失,所以本研究仅注重患者负重影响,患者步行过程中的单腿站立情况已进行模拟。对于患者术后跳跃、上下阶梯、下蹲及斜坡等动作未进行模拟,结论可能有相对偏倚。
本研究的结果表明,理论上,假体重建模型的初期稳定性、抗旋转能力可以得到保证,模型早期的强度由假体、螺钉提供。由于假体远端组件采用3D 打印技术制作,与距骨接触界面为金属骨小梁结构,骨长入迅速,不愈合率显著降低。随着后期骨长入的实现,可以减小螺钉的应力,从而避免了由于螺钉使用疲劳导致的假体松动、距骨塌陷并发症。
综上所述,3D 打印踝关节融合假体重建胫骨下段恶性骨肿瘤切除后的骨缺损模型中假体及骨受力均匀,稳定性好,是一种理论上可靠的重建策略。尽管中期随访结果满意,但仍须长期随访结果来验证其临床疗效。
参考文献
[1] Zhao Z,Yan T,Guo W,et al.Surgical options and reconstruction strategies for primary bone tumors of distal tibia: a systematic review of complications and functional outcome[J].J Bone Oncol,2019,14:100209.DOI: 10.1016/j.jbo.2018.100209.
[2] Sambri A,Dalla Rosa M,Scorianz M,et al.Different reconstructive techniques for tumours of the distal tibia[J].Bone Joint J,2020,102-b(11):1567-1573.DOI: 10.1302/0301-620X.102B11.BJJ-2020-0127.R1.
[3] Gundavda MK,Agarwal MG,Reddy R,et al.Reconstructive challenges of distal tibia bone tumors: extracorporeally irradiated autograft combined with a nonvascularized autograft fibula for superior reconstruction and functional outcomes when compared to ipsilateral pedicled fibula transfer alone[J].Sarcoma,2021,2021:6624550.DOI:10.1155/2021/6624550.
[4] Migliorini F,La Padula G,Torsiello E,et al.Strategies for large bone defect reconstruction after trauma,infections or tumour excision: a comprehensive review of the literature[J].Eur J Med Res,2021,26(1):118.DOI: 10.1186/s40001-021-00593-9.
[5] Zhao ZQ,Yan TQ,Guo W,et al.Surgical treatment of primary malignant tumours of the distal tibia: clinical outcome and reconstructive strategies[J].Bone Joint J,2018,100-b(12):1633-1639.DOI: 10.1302/0301-620X.100B12.BJJ-2018-0779.R1.
[6] 牛天立,杨毅,梁海杰,等.胫骨下段 3D 打印踝关节融合型肿瘤假体在骨肉瘤广泛切除术中的应用[J].中华骨科杂志,2022,42(5):272-280.DOI: 10.3760/cma.j.cn121113-20200718-00455.
[7] Qiu TX,Teo EC,Yan YB,et al.Finite element modeling of a 3D coupled foot-boot model[J].Med Eng Phys,2011,33(10):1228-1233.DOI: 10.1016/j.medengphy.2011.05.012.
[8] Anwar A,Zhang Z,Lv D,et al.Biomechanical efficacy of AP,PA lag screws and posterior plating for fixation of posterior malleolar fractures: a three dimensional finite element study[J].BMC Musculoskelet Disord,2018,19(1):73.DOI: 10.1186/s12891-018-1989-7.
[9] Anwar A,Lv D,Zhao Z,et al.Finite element analysis of the three different posterior malleolus fixation strategies in relation to different fracture sizes[J].Injury,2017,48(4):825-832.DOI:10.1016/j.injury.2017.02.012.
[10] Fan Y,Xiu K,Duan H,et al.Biomechanical and histological evaluation of the application of biodegradable poly-L-lactic cushion to the plate internal fixation for bone fracture healing[J].Clin Biomech (Bristol,Avon),2008,23(Suppl 1):S7-S16.DOI: 10.1016/j.clinbiomech.2008.01.005.
[11] Huang S,Ji T,Guo W.Biomechanical comparison of a 3D-printed sacrum prosthesis versus rod-screw systems for reconstruction after total sacrectomy: a finite element analysis[J].Clin Biomech (Bristol,Avon),2019,70:203-208.DOI: 10.1016/j.clinbiomech.2019.10.019.
[12] Abudu A,Grimer RJ,Tillman RM,et al.Endoprosthetic replacement of the distal tibia and ankle joint for aggressive bone tumours[J].Int Orthop,1999,23(5):291-294.DOI:10.1007/s002640050374.
[13] Lee SH,Kim HS,Park YB,et al.Prosthetic reconstruction for tumours of the distal tibia and fibula[J].J Bone Joint Surg Br,1999,81(5):803-807.DOI: 10.1302/0301-620x.81b5.9588.
[14] Natarajan MV,Annamalai K,Williams S,et al.Limb salvage in distal tibial osteosarcoma using a custom mega prosthesis[J].Int Orthop,2000,24(5):282-284.DOI: 10.1007/s002640000172.
[15] Shekkeris AS,Hanna SA,Sewell MD,et al.Endoprosthetic reconstruction of the distal tibia and ankle joint after resection of primary bone tumours[J].J Bone Joint Surg Br,2009,91(10):1378-1382.DOI: 10.1302/0301-620X.91B10.22643.
[16] Yang P,Evans S,Khan Z,et al.Reconstruction of the distal tibia following resection of aggressive bone tumours using a custom-made megaprosthesis[J].J Orthop,2017,14(3):406-409.DOI: 10.1016/j.jor.2017.06.003.
[17] Stevenson JD,Wigley C,Burton H,et al.Minimising aseptic loosening in extreme bone resections: custom-made tumour endoprostheses with short medullary stems and extra-cortical plates[J].Bone Joint J,2017,99-b(12):1689-1695.DOI:10.1302/0301-620X.99B12.BJJ-2017-0213.R1.
[18] Grimer RJ,Aydin BK,Wafa H,et al.Very long-term outcomes after endoprosthetic replacement for malignant tumours of bone[J].Bone Joint J,2016,98-b(6):857-864.DOI:10.1302/0301-620X.98B6.37417.
论文信息:
作者:赵志庆 王冀川 燕太强 郭卫 杨荣利 汤小东
DOI:10.3969/j.issn.2095-252X.2023.12.002
中图分类号:R687.4
作者单位:100044 北京大学人民医院骨与软组织肿瘤治疗中心
通讯作者:燕太强,Email: yantqzh@163.com
Correspondence author: YAN Tai-qiang,Email: yantqzh@163.com
(收稿日期:2023-02-04)
(本文编辑:李贵存)
l 谷专栏 l
欢迎高校及科研机构、企业科学家加入谷专栏,与业界分享对推动增材制造发展起关键作用的共性基础科研与应用成果,欢迎扫描下方图片二维码提交您的信息。
白皮书下载 l 加入3D科学谷QQ群:106477771
网站投稿 l 发送至2509957133@qq.com
欢迎转载 l 转载请注明来源3D科学谷