2020年6月23日,硅谷医疗3D打印创新平台3DHEALS(3dheals.com)的“专家角 / Expert’s Corner” 专栏发表了由3D科学谷联合创始人朱琳撰写的专栏文章’ Progress in Commercialization of 3D Printed Orthopedic Implants in China Since 2019′。本期3D科学谷将分享发表在3DHEALS的原文及中文译文。
 3DHEALS Expert’s Corner。来源:3DHEALS
3DHEALS Expert’s Corner。来源:3DHEALS
在2019年“3DHEALS Expert’s Corner”专栏文章《3D打印骨科植入物在中国的应用概况以及商业转化中的挑战》中,我们回顾了2019年之前,中国的骨科3D打印植入物商业转化概况。相比欧美市场,中国骨科医疗器械制造商在3D打印骨科植入物商业转化方面的进展较慢。
不过,2019年以来,中国骨科3D打印植入物的商业转化出现了明显的加速跑趋势。在本期专栏中,我们将从中国2019年以来新增上市3D打印植入物产品、定制式医疗器械监督管理规定、产品注册技术审查指导原则、团体标准四个角度,回顾2019年至今,中国骨科3D打印植入物的商业化进展。
l 新增上市3D打印产品
爱康医疗
爱康医疗是中国3D打印金属植入物研发、制造与商业应用等方面的开拓者,同时也是亚太地区规范化的骨科3D打印金属植入物制造商。
2015-2016年,北京爱康宜诚医疗器材股份有限公司从国家药品监督管理局获得了三个3D打印植入物注册证:髋臼部件和椎体假体、椎间融合器。2020年,爱康新增两款获得国家医疗器械监督局Ⅲ类器械注册证的3D打印植入物产品,分别是:金属3D打印骨盆缺损匹配假体与金属3D打印定制化颈椎融合体。
3D打印植入物已成为爱康医疗的核心产品之一。2019年3D打印产品营收超过1.23亿元,占总收入的13.3%。
嘉思特医疗
2019年7月12日,嘉思特的骨小梁髋关节假体产品获得国家医疗器械监督局Ⅲ类器械注册证。嘉思特开发了3种型号的3D打印髋臼杯:骨小梁髋臼-DDH与骨小梁髋臼-标准型与骨小梁髋臼-翻修。3种型号均采用电子束熔融3D打印技术制造。
l 定制式医疗器械监督管理规定
2020年1月1日中国《定制式医疗器械监督管理规定(试行)》正式实施。中国国家药品监督管理局对该规定的解读,包括四个关键要点:
1. 定制式植入物使用,而患者匹配型不适用;
个性化医疗器械是指医疗器械生产企业根据医疗机构经授权的医务人员提出的临床需求设计和制造的、满足患者个性化要求的医疗器械,分为定制式医疗器械和患者匹配医疗器械。
2. 采用备案的方式进行监管;
与标准化批量生产的医疗器械不同,定制式医疗器械无需经过漫长的实验与审批管理周期,而是按规定实行上市前备案管理。
定制式医疗器械生产企业与医疗机构共同作为备案人,在生产、使用定制式医疗器械前应当向医疗器械生产企业所在地(进口产品为代理人所在地)省、自治区、直辖市药品监督管理部门备案。从风险控制的角度出发,定制式医疗器械不得委托生产,备案人应当具备相应条件。
3. 设计加工特殊要求涉及人员、设计开发、质量控制、追溯管理。
4. 当一种定制式植入物的使用数量达到上市前审批要求之后,可对此类植入物注册。
根据3D科学谷的市场观察,在该规定正式实施后,爱康医疗与春立正达开展了多个定制式植入物的备案申请。 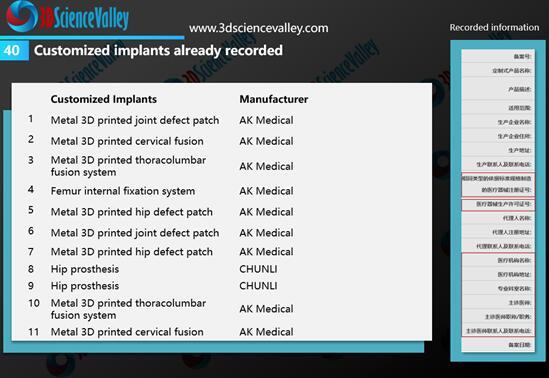 图:爱康与春立正达已备案的定制式植入物。来源:《3D打印与骨科植入物白皮书3.0》(七月发布)
图:爱康与春立正达已备案的定制式植入物。来源:《3D打印与骨科植入物白皮书3.0》(七月发布)
从上图中的右图可以看到,备案信息中需要注明使用植入物的医院、医生,也就是这款植入物仅限于备案中提及的医生使用,而不能在其他用途中使用。
l 产品注册技术审查指导原则
从全球骨科3D打印植入物商业转化情况来看,进展最快的是3D打印髋臼杯与脊柱植入物(尤其是融合器)。下图显示了全球范围内典型的3D打印髋臼杯产品,3D打印髋臼杯的商业化最早在2007年就开始了。
 图:3D打印髋臼杯商业化进展。来源:《3D打印与骨科植入物白皮书3.0》(七月发布)
图:3D打印髋臼杯商业化进展。来源:《3D打印与骨科植入物白皮书3.0》(七月发布)
中国国家医疗器械监督管理局也在推动髋臼杯、脊柱融合器与人工椎体3D打印植入物的商业转化。2019年,他们发布了以上三类标准化3D打印植入物的技术审查指导原则征求意见稿。
l 团体标准
在3D打印医疗器械专业委员会的推动下,中国3D打印医疗器械第一批五项团体标准在2019年7月20日正式实施。
第一批五项团体标准包括:《定制式医疗器械力学等效模型》、《定制式医疗器械质量体系特殊要求》、《匹配式人工颞下颌关节》、《定制式增材制造医疗器械的互联网实现条件的通用要求》、《定制式医疗器械医工交互全过程监控及判定指标与接收条件》。
l 总结
相关法规和标准的缺失,是制约3D打印医疗器械在中国产业化应用的主要挑战。2019年以来,除了新增的上市产品,中国在3D打印植入物相关技术审查指导原则、管理规定以及团体标准方面取得了突破性的进展。法规与标准的建立、完善,将推动中国3D打印骨科植入物进入产业化加速跑之路。
白皮书下载,加入3D科学谷产业链QQ群:529965687
网站投稿请发送至2509957133@qq.com
欢迎转载,长期转载授权请留言

















